中国の医薬品特許紛争早期解決
メカニズムに関する諸規定及び施行状況
改正中国専利法(専利とは、特許、実用新案、意匠の総称である)は、2020年10月の第4次改正において、第76条に医薬品特許紛争早期解決メカニズムを設けることが決定し、2021年6月1日より施行された。医薬品特許紛争早期解決メカニズムとは、医薬品の販売許可手続と、関連する医薬品の特許紛争手続が連動する制度を指し、台湾で2019年8月20日より施行して既に2年が経過した西洋薬のパテントリンケージ制度に相当する。改正後の専利法の施行に合わせて、2021年7月から関連規定が次々に公布され、【中国市販医薬品特許情報登録プラットフォーム】(以下【特許情報登録プラットフォーム】という)も7月4日より正式に運用が開始された。
まず、国家薬品監督管理局と国家知識産権局は、2021年7月4日に共同で《医薬品特許紛争早期解決メカニズムの実施弁法(試行)》(以下《実施弁法(試行)》という)を発布し、国家薬品監督管理局は、同日に《実施弁法(試行)》の関連事項の実施を通告した。《実施弁法(試行)》は計16条あり、発布の日より施行された。主な内容は以下のとおりである。
ü 国家薬品審査評価機構が【特許情報登録プラットフォーム】を構築し、関連情報を公開する。(第三条)
ü 医薬品販売許可の所持者は、医薬品登録証書を取得後30日以内に自ら医薬品の名称、剤型、規格や特許権に関する情報を登録しなければならない。(第四条)
ü 化学ジェネリック医薬品申請者は、医薬品販売許可の申請を提出するとき、関連する先発医薬品に係る医薬品特許ごとに声明(4種類に分けられる)を出さなければならない。(第六条)
ü 特許権者又は利害関係者は、第4類声明について異議がある場合、国家薬品審査評価機構が医薬品販売認可申請を公開した日から45日以内に、販売申請に係る医薬品の関連技術内容が関連特許の保護範囲に入る否かについて人民裁判所に訴訟を提起し、又は国務院専利行政部門に行政裁決を請求することができる。また、行政裁決に不服がある場合には、人民裁判所に訴訟を提起することができる。(第七条)
ü 国務院薬品監督管理部門は、化学ジェネリック医薬品の登録申請に対して9ヶ月の待機期間を1回のみ設定する。(第八条)
ü 最初に特許権へのチャレンジに成功し且つ最初に販売許可を取得した化学ジェネリック医薬品には、12ヶ月の市場独占期間が与えられる。(第十一条)
また、最高人民裁判所も7月4日に、計14の条文からなる《最高人民裁判所による登録申請医薬品に係る特許権紛争民事事件の審理における法律適用の若干問題に関する規定》を公布した。同規定は、翌日から施行された。その主な内容は以下のとおりである。
ü 当事者が提起した特許の保護範囲に入るか否かの確認に係る紛争の第一審事件は、北京知的財産裁判所が管轄する。(第一条)
ü 訴訟を提起する場合には、【特許情報登録プラットフォーム】に登録された関連特許の資料を提出しなければならない。(第三条)
ü 当事者は、訴訟中に取得した営業秘密又はその他秘密保持すべき営業情報について秘密保持義務を負い、無断で開示したりした場合、法律により民事責任を負う。(第八条)
ü 特許権者又は利害関係者が、訴訟中に行為保全を申立てて、医薬品販売許可申請者が専利法第11条に規定される行為を実施することを禁止するよう求めた場合、人民裁判所は、専利法、民事訴訟法の関連規定に従って処理する。(第十条)
ü 無効宣告を受けるべき又は登録申請医薬品の範囲に含まれない特許権と知りながら提起された訴訟で、勝訴を得た医薬品販売許可申請者は、北京知的財産裁判所に損害賠償請求訴訟を提起することができる。(第十二条)
また、国家知識産権局は、7月5日に《医薬品特許紛争早期解決メカニズム行政裁決弁法》(以下、《行政裁決弁法》という)及び行政裁決の請求方式(郵送又は窓口に提出)と提出資料の様式を定めた《医薬品特許紛争早期解決メカニズム行政裁決受理事項》を公告した。《行政裁決弁法》は計24条あり、公布の日より施行された。その主な内容は以下のとおりである。
ü 国家知識産権局は、専利法第76条における行政裁決処理業務を担当し、医薬品特許紛争の行政裁決事件を審理するとき、合議体を設置しなければならない。合議体は当事者の申立及び事件の状況に応じて、口頭審理又は書面審理を行うことができる。(第二条、第十三条)
ü 当事者は国家知識産権局に医薬品特許紛争の行政裁決を請求する場合、「明確な被請求人がいる」、「明確な請求事項と具体的な事実・理由がある」等の七つの要件を満たさなければならない。(第四条)
ü 当事者は医薬品特許紛争の行政裁決を請求する場合、請求書のほか、主体資格証明、【特許情報登録プラットフォーム】に登録した特許関連資料などを提出しなければならない。請求書には規定された必要事項を記載しなければならない。(第七条と第八条)
ü 請求書と関連書類に不備があるなどの場合、請求人に5営業日以内に補正するよう通知しなければならず、期間内に補正しなかった又は補正しても同様の不備がある場合、当該行政裁決の請求は受理しない。(第九条)
ü 医薬品特許紛争の行政裁決の請求が、「被請求人が不明確である」、「同一の医薬品紛争事件が既に人民裁判所に受理された」などの事情のいずれかに該当する場合、国家知識産権局は請求を受理せず、且つ請求人に通知する。(第十条)
ü 国家知識産権局は、医薬品特許紛争の行政裁決事件を審理するとき、当事者の意思に応じて調停を行うことができる。調停が不成立の場合は、速やかに行政裁決を出さなければならない。(第十五条)
ü 「当事者の一方が死亡し、相続人が事件の処理に参加するか否か意思表示するのを待つ必要がある場合」、「当事者の一方が不可抗力事由により審理に参加することができない場合」、「その他処理を中断する必要がある場合」などの事情のいずれかに該当する場合、当事者は、事件の処理を中断するよう請求することができる。国家知識産権局も、職権により事件の処理の中断を決定することができる。(第十六条)
ü 当事者は、国家知識産権局が下した医薬品特許紛争の行政裁決に不服がある場合、人民裁判所に訴訟を提起することができる。(第十九条)
【特許情報登録プラットフォーム】にある「特許声明リスト」の登録資料によると、2021年7月4日から9月30日までに特許声明がなされた案件は380件を超えており、そのうち化学医薬品が9割以上を占め、治療用生物製剤は僅か6件で、漢方薬の特許声明はまだ登録されていない(図1)。また、登録済みの特許声明の中で、第4類声明をした案件は19件であった(表1)。最初に特許権へのチャレンジを出した会社は、江蘇豪森薬業グループで、7月26日にアストラゼネカ社に第4.2類声明(ジェネリック医薬品は、【特許情報登録プラットフォーム】に登録された関連特許の保護範囲に含まれていない)を出した。続いて、哈爾濱三聯薬業股份有限公司が8月10日にHospira Incに対して第4.1類声明(【特許情報登録プラットフォーム】に登録された関連特許は特許無効が宣告されるべきである)を出した。今後も医薬品特許紛争早期解決メカニズムの施行状況と、中国で最初に特許権へのチャレンジに成功した医薬品業者がいつ誕生するかに注目していきたい。
図1:「特許声明リスト」に登録済みの案件数
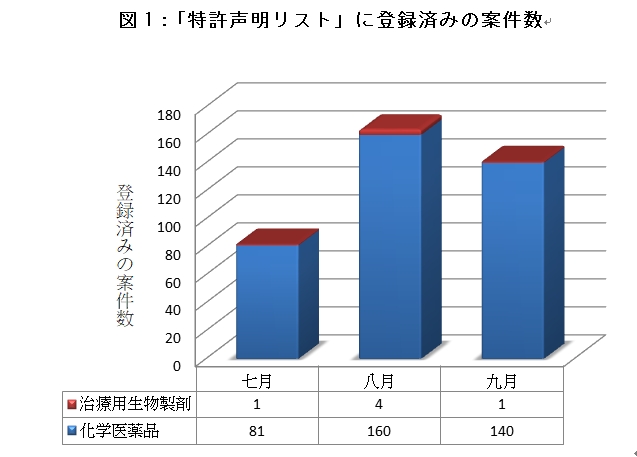
表1:2021.07.04~2021.09.30までの登録済みの第4類声明のリスト

|