中國大陸首例藥品專利連結訴訟,
仿製藥未落入涉案專利權之保護範圍
【資料來源:京法網事】
北京知識產權法院2022年4月15日公開宣判原告中外製藥株式會社訴被告溫州海鶴藥業有限公司確認是否落入專利權保護範圍糾紛一審案件,涉案仿製藥並未落入涉案專利權的保護範圍,判決駁回原告的訴訟請求。
本案為中國大陸2020年10月新《專利法》實施、藥品專利連結制度建立後,首例藥品專利連結訴訟案件,原告不服判決,已經當庭表示提起上訴。
n 當事人
原告:中外製藥株式會社
被告:溫州海鶴藥業有限公司
n 涉案專利:第200580009877.6號發明專利(以下簡稱「涉案專利」)
n 中國大陸相關規定
(一) 中國大陸專利法新增第76條(2020年10月)--法律依據
ü 專利法第76條
藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關係人,因申請註冊的藥品相關的專利權產生糾紛的,相關當事人可以向人民法院起訴,請求就申請註冊的藥品相關技術方案是否落入他人藥品專利權保護範圍作出判決。國務院藥品監督管理部門在規定的期限內,可以根據人民法院生效裁判作出是否暫停批准相關藥品上市的決定。
藥品上市許可申請人與有關專利權人或者利害關係人也可以就申請註冊的藥品相關的專利權糾紛,向國務院專利行政部門請求行政裁決。
國務院藥品監督管理部門會同國務院專利行政部門制定藥品上市許可審批與藥品上市許可申請階段專利權糾紛解決的具體銜接辦法,報國務院同意後實施。
(二) 中國大陸藥品監督管理局2021年第46號公告:《藥品專利糾紛早期解決機制實施辦法(試行)》(2021年7月4日)--基本架構
1. 即日(2021年7月4日)起,中國大陸上市藥品專利資訊登記平台正式運行。請相關藥品上市許可持有人根據需要提前在中國大陸上市藥品專利資訊登記平台完成相關藥品專利資訊登記與主動公開。
2. 即日起,申請人提交化學仿製藥、中藥同名同方藥、生物類似藥上市註冊申請時,應對照已在中國大陸上市藥品專利資訊登記平台公開的相關藥品專利資訊,按《辦法》要求提交專利聲明,並將聲明及聲明依據通知上市許可持有人。未提交專利聲明的,補正後方予以受理。
(三) 中國大陸最高人民法院關於審理申請註冊的藥品相關的專利權糾紛民事案件適用法律若干問題的規定(法釋〔2021〕13號,以下簡稱《審理規定》)(2021年7月5日)--司法途徑操作指南
ü 第一條 [專屬管轄]
當事人依據專利法第七十六條規定提起的確認是否落入專利權保護範圍糾紛的第一審案件,由北京知識產權法院管轄。
ü 第二條 [定義]
專利法第七十六條所稱相關的專利,是指適用國務院有關行政部門關於藥品上市許可審批與藥品上市許可申請階段專利權糾紛解決的具體銜接辦法(以下簡稱銜接辦法)的專利。
專利法第七十六條所稱利害關係人,是指前款所稱專利的被許可人、相關藥品上市許可持有人。
ü 第四條 [提起確認之訴請求權人]
專利權人或者利害關係人在銜接辦法規定的期限內未向人民法院提起訴訟的,藥品上市許可申請人可以向人民法院起訴,請求確認申請註冊藥品未落入相關專利權保護範圍。
ü 第六條 [訴訟後不得再以提專利無效為由中止訴訟]
當事人依據專利法第七十六條起訴後,以國務院專利行政部門已經受理宣告相關專利權無效的請求為由,申請中止訴訟的,人民法院一般不予支持。
ü 第十條 [行為保全範圍]
專利權人或者利害關係人在專利法第七十六條所稱訴訟中申請行為保全,請求禁止藥品上市許可申請人在相關專利權有效期內實施專利法第十一條規定的行為的,人民法院依照專利法、民事訴訟法有關規定處理;請求禁止藥品上市申請行為或者審評審批行為的,人民法院不予支持。
(四) 國家知識產權局發佈《藥品專利糾紛早期解決機制行政裁決辦法》(以下簡稱《行政裁決辦法》2021年7月5日)--行政途徑操作指南
ü 第四條 [行政裁決要件]
當事人請求國家知識產權局對藥品專利糾紛進行行政裁決的,應當符合下列條件:
(一)請求人是專利法第七十六條所稱的藥品上市許可申請人與有關專利權人或者利害關係人,其中的利害關係人是指相關專利的被許可人或者登記的藥品上市許可持有人;
(二)有明確的被請求人;
(三)有明確的請求事項和具體的事實、理由;
(四)相關專利資訊已登記在中國上市藥品專利資訊登記平台上,且符合《藥品專利糾紛早期解決機制實施辦法》的相關規定;
(五)人民法院此前未就該藥品專利糾紛立案;
(六)藥品上市許可申請人提起行政裁決請求的,自國家藥品審評機構公開藥品上市許可申請之日起四十五日內,專利權人或者利害關係人未就該藥品專利糾紛向人民法院起訴或者提起行政裁決請求;
(七)一項行政裁決請求應當僅限於確認一個申請上市許可的藥品技術方案是否落入某一項專利權的保護範圍。
ü 第十九條 [行政轉司法]
當事人對國家知識產權局作出的藥品專利糾紛行政裁決不服的,可以依法向人民法院起訴。
n 事實摘要暨說明
1. 原告為涉案專利「ED-71製劑」的專利權人,也是相關上市專利藥品「艾地骨化醇軟膠囊」的上市許可持有人,該藥品主要用來治療骨質疏鬆。
2. 原告就上述藥品和涉案專利已按規定,登記在「中國大陸上市藥品專利資訊登記平台」。
說明:
這個上市藥品專利資訊登記平台是為了讓在中國大陸境內註冊上市的藥品資訊公開所設,化學藥、中藥、生物製品的藥品上市許可持有人都可在獲得藥品註冊證後30日內,自行在平台登記藥品名稱、劑型、規格、上市許可持有人、相關專利號、專利名稱、專利權人、專利被授權人、專利核准日期及保護期限屆滿日、專利狀態、專利類型、藥品與相關專利權利要求的對應關係、通訊地址、聯絡人等內容。
但並非所有類型的專利都可以作為「相關專利」在平台上登記,例如:代謝產物、中間體、晶型、檢測方法、製備方法等專利就不包括在「相關專利」範圍。
是否在平台上登記不具有強制性,如果藥品上市許可持有人選擇不在平台上登記,那這個專利就不適用藥品專利連結制度。
3. 原告發現被告除了向國家藥監部門申請註冊了名稱為「艾地骨化醇軟膠囊」的仿製藥上市許可申請,也在中國大陸上市藥品專利資訊登記平台就上述仿製藥作出了第4.2類聲明,亦即聲明其仿製藥未落入相關專利權保護範圍。
說明:
根據《藥品專利糾紛早期解決機制實施辦法(試行)》規定,仿製藥(包含化學仿製藥、中藥同名同方藥、生物類似藥)的申請人,在提交藥品上市許可申請時,應對照在平台公開的專利資料,針對被仿製藥的每一件相關藥品專利作出聲明。聲明共分為四類:
第一類聲明:平台中沒有被仿製藥的相關專利資料。
第二類聲明:平台收錄的被仿製藥相關專利權已經終止或被宣告無效,或被仿製藥申請人已獲得專利權人相關專利實施授權。
第三類聲明:平台有收錄被仿製藥的相關專利,仿製藥申請人承諾在相應專利權有效期屆滿之前所申請的仿製藥暫不上市。
第四類聲明:平台收錄的被仿製藥相關專利權應被宣告無效,或其仿製藥未落入相關專利權保護範圍內。
針對仿製藥申請人所提的聲明,《藥品專利糾紛早期解決機制實施辦法(試行)》規定了「審評機構公開+仿製藥申請人通知聲明」的要求,使藥品上市許可持有人和專利權人能充分知悉仿製藥專利聲明內容,並保證後續程序順利進行。仿製藥申請被受理後10個工作天內,中國大陸的藥品審評機構就應在平台公開申請資訊和相應聲明,而仿製藥申請人應將相關聲明通知上市許可持有人,若上市許可持有人非專利權人,由上市許可持有人通知專利權人;通知方式則應採紙本和電子郵件形式寄出。聲明未落入相關專利權保護範圍內者,聲明依據應包括仿製藥技術方案和相關專利的相關權利要求比對表及相關技術資料。
4. 小結:原告依據新《專利法》第76條規定向北京知識產權法院提起確認是否落入專利權保護範圍糾紛,請求確認被告申請註冊的仿製藥「艾地骨化醇軟膠囊」落入涉案專利的保護範圍。
本件的「藥品專利連結訴訟」,是一種新的案件類型,第一審由北京知識產權法院專屬管轄,案由為「確認是否落入專利權保護範圍糾紛」,也就是說這類案件均為「確認之訴」,這是和傳統專利侵權訴訟的給付訴訟最大根本的不同。
其次,這類案件可由專利權人或利害關係人(包括專利被授權人、相關藥品上市許可持有人)在對四類專利聲明有異議時提起,這裡的被授權人也包括專屬授權契約的被授權人、非專屬授權契約(權利人不提訴)的被授權人,及經權利人明確授權的一般授權契約的被授權人。本案的原告是有在平台登記的專利權人,有權提起專利連結訴訟。
此外,原告有權在專利連結訴訟中申請行為保全,但無權禁止藥品上市申請行為或審評審批行為(《審理規定》第10條)。一旦進入訴訟程序,即使被告另提起專利無效宣告請求,藥品專利連結訴訟也不會中止(《審理規定》第6條)。
對於仿製藥申請人作的四類專利聲明有異議的專利權人或利害關係人,除了提起訴訟外,根據《行政裁決辦法》第4條第1項第6款,也可以自藥品審評機構公開藥品上市許可申請之日起45日內以藥品上市許可申請人為被請求人,就申請上市藥品的相關技術方案是否落入相關專利權保護範圍向國知局請求行政裁決。行政裁決的處理時限更短,但若選擇行政裁決,必須是尚未就該藥品專利糾紛向人民法院起訴;如果對行政裁決結果不服,才可以再向人民法院起訴。也就是說,若一開始就選擇司法途徑,就不能再透過行政途徑解決;若一開始選擇行政途徑,還可以繼續選擇司法途徑。
如果專利權人或利害關係人未在藥品上市許可申請之日起45日內提起訴訟也未請求行政裁決,仿製藥申請人可以自己提起訴訟或請求行政裁決,以確認相關藥品技術未落入相關專利權保護範圍。因此,原研發藥廠有必要積極密切注意這四類專利聲明,並在規定時限內作出回應;而仿製藥廠則應提前評估所申請上市的仿製藥落入所登記的專利範圍之可能性,並提前作出提起「不落入相關專利權保護範圍」訴訟或請求行政裁決的準備。
n 北京知識產權法院審理結果
法院審理後認為:涉案仿製藥使用的技術方案與涉案專利權利要求1的技術方案既不相同,亦不等同,故該技術方案未落入涉案專利權利要求1的保護範圍。鑒於權利要求2-6為權利要求1的從屬權利要求,在涉案仿製藥的技術方案未落入權利要求1的保護範圍的情況下,其亦不落入權利要求2-6的保護範圍。據此,原告有關涉案仿製藥落入涉案專利權利要求1-6的保護範圍的主張不能成立,法院不予支持。
n 藥品審評審批流程
藥品研發若價格過高,就可能影響使用普及率,仿製藥成本較低,但也不能因此犧牲原研發藥廠的利潤;因此,專利法利用「藥品專利連連結制度」來達到平衡。本案是中國大陸第一例藥品專利連結訴訟,被告申請的上市專利藥品「艾地骨化醇軟膠囊」(化學藥)相關審批流程,在此也順帶簡單介紹。
根據《藥品專利糾紛早期解決機制實施辦法(試行)》政策解讀,專利權人或利害關係人若對化學仿製藥註冊申請的四類專利聲明有異議,可以自國家藥品審評機構公開藥品上市許可申請之日起45日內,就申請上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門請求行政裁決。專利權人或者利害關係人如在規定期限內提起訴訟或者請求行政裁決,應自人民法院立案或國務院專利行政部門受理之日起15個工作日內將立案或受理通知書副本提交國家藥品審評機構,並通知仿製藥申請人。收到人民法院立案或者國務院專利行政部門受理通知書副本後,國務院藥品監督管理部門對化學仿製藥註冊申請設置9個月的等待期。
對化學仿製藥申請人聲明中國大陸上市藥品專利資訊登記平台收錄的被仿製藥相關專利權應被宣告無效的,如果專利權人或利害關係人未就上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門請求行政裁決,不啟動等待期。
Ø 國務院藥品監督管理局將針對本案仿製藥,啟動9個月等待期,等待期內國務院藥品監督管理局不會停止對此仿製藥的技術審評
通過技術審評:
à國家藥品審評機構結合法院判決,作出相應處理:
A. 確認落入相關專利權保護範圍者,待專利權期限屆滿前轉入行政審批(暫緩批准);
B. 確定不落入相關專利權保護範圍或雙方和解者,轉入行政審批;
C. 相關專利權被依法無效者,轉入行政審批;
D. 超過等待期,國務院藥品監督管理局未受到人民法院的生效判決或調解書者,轉入行政審批;
E. 國務院藥品監督管理局在行政審批期間受到人民法院的生效判決,確認落入相關專利權保護範圍者,待專利權期限屆滿前轉入行政審批(暫緩審批)。
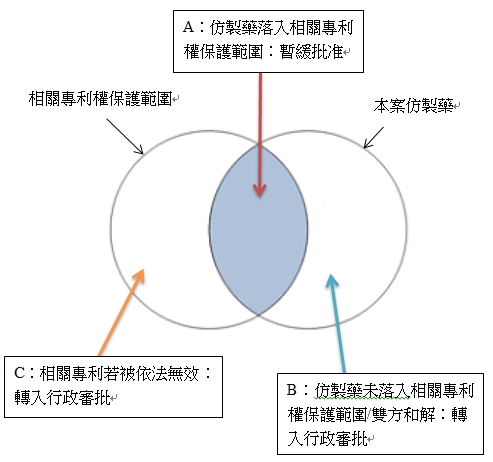
國務院藥品監督管理局作出暫緩批准的決定後,若出現以下情形之一者,被告得向國務院藥品監督管理局申請批准仿製藥上市:
1. 人民法院推翻原行政裁決;
2. 雙方和解;
3. 相關專利權被宣告無效;
4. 原告撤回訴訟。
在此要特別注意的是,9個月等待期制度只適用於化學仿製藥+申請人作出第四類聲明+專利權人/利害關係人在期限內提起訴訟/行政裁決;若是作第一類或第二類聲明的化學仿製藥,國務院藥品監督管理局根據技術審評就能決定是否批准上市。作第三類聲明的化學仿製藥,若通過技術審評,作出批准上市決定,還是要等到相應專利權有效期和市場獨佔期屆滿後才能上市。
|